Autores: Dr. Redmond Burke, jefe de Cirugía Cardiovascular, y Dr. Anthony Rossi, jefe de Medicina Cardiovascular.
Introducción:
El Instituto del Corazón de Nicklaus Children’s Hospital permanece enfocado en brindar la mejor y más segura experiencia para pacientes que se someten a una cirugía congénita del corazón. En este informe, se repasarán los 24 años de experiencia quirúrgica del programa en el tratamiento de niños con un diagnóstico de tronco arterial.
Métodos:
Revisamos nuestra base de datos de CardioAccess a fin de identificar a los pacientes que se sometieron a una reparación del tronco arterial desde septiembre de 1995 hasta febrero de 2019.
La imagen digital de la cirugía correspondiente al procedimiento de cada paciente se usó de forma rutinaria para documentar la anatomía y reparación de cada lesión. Se grabaron todas las cirugías con una cámara ubicada en el extremo de la mesa de cirugía, el video fue visible para todo el equipo durante el procedimiento y se almacenó de forma digital para una revisión de desempeño a pedido.
Éxitos de la cirugía clínica, Redmond Burke 2019:
Canulación: canulación bicava, pinzamiento y cardioplegía, ventrículo auricular izquierdo.
En el caso de tronco con IAA (interrupción del arco aórtico): baje la temperatura a 20 °C, acceda al bypass de flujo inferior con una cánula de 10 Fr en el tronco braquiocefálico, movilice la aorta descendente con cauterización, retire en la tercera arteria intercostal según sea necesario. Tire la aorta y realice una anastomosis en la aorta ascendente a nivel braquiocefálico. Libere el aire y vuelva a colocar la cánula aórtica; reanude el flujo completo y eleve la temperatura a 28 grados.
En el caso de reparación del tronco: realice un pinzamiento transversal en la parte superior; haga una pequeña incisión transversal en la aorta ascendente anterior; verifique la posición del ostium coronario; luego, realice una sección transversal en la aorta y deje las dos arterias pulmonares juntas como un botón, si es posible. Inspeccione la válvula truncal y repare, si es necesario. Llene el botón de la arteria pulmonar con parche de pericardio nativo usando polipropileno 7-0 líquido; vuelva a verificar el ostium coronario. Vuelva a conectar la aorta ascendente y descendente con polipropileno 7-0 líquido; realice una incisión en el RV (ventrículo derecho) y evite las arterias coronarias; luego, extirpe los paquetes musculares en el RVOT (tracto de salida de ventrículo derecho). Corte el parche de pericardio nativo según la forma del VSD (defecto septal ventricular). Repare el VSD sin ninguna técnica de toque usando polipropileno 8-0 líquido.
Prepare el homoinjerto pulmonar (tamaño según el paciente y la disponibilidad: de 7 a 12 mm); corte para corregir la longitud, realice una anastomosis distal en el botón de la arteria pulmonar con polipropileno 7-0. Manguito del homoinjerto proximal suturado en la incisión en el RV distal del epicardio. Cree una cubierta del perdicardio para el manguito anterior del homoinjerto y el resto de la incisión en el RV con polipropileno 7-0 o 6-0 líquido. Abra la aurícula derecha y repare la ASD (comunicación interauricular) con polipropileno 7-0; cierre la aurícula con polipropileno 7-9 en dos capas.
Vuelva a subir la temperatura; realice una TEE (ecocardiografía transesofágica) intraoperatoria; verifique la gradiente del arco si existe IAA; abra el pecho de forma selectiva; use electrodos solo si es necesario (poco frecuente).
Resultados:
Hubo 41 neonatos y lactantes a los que se sometió a la reparación del tronco durante este período (21 de sexo masculino, 20 de sexo femenino). Un neonato nacido con bajo peso prematuro con tronco arterial y un paciente con IAA recibieron cuidados paliativos con la colocación de bandas arteriales pulmonares bilaterales antes de la reparación. La reparación completa se realizó 26 días después de los cuidados paliativos iniciales. Hubo 5 pacientes que requirieron reparación del IAA y 1 paciente al cual se lo sometió a una reparación de la válvula truncal al momento de la cirugía. El peso promedio al momento de la cirugía de estos niños era de 3 kg (con una variación de 1.5 a 4.3 kg). Hubo 21 pacientes con <3 kg y 9 con <2.5 kg al momento de la cirugía. Se los sometió a la cirugía a una edad promedio de 10 días (de 2 a 85 días). Hubo 34 cirugías neonatales. Hubo 1 muerte (tasa de supervivencia del 98 %). El promedio de estadía posoperatoria fue de 17 días. Hubo 11 pacientes con una anomalía cromosómica documentada o síndrome fenotípico. El tiempo del bypass cardiopulmonar fue en promedio de 183 minutos. El tiempo del pinzamiento transversal de la aorta fue de 107 minutos. Tres pacientes requirieron paro circulatorio hipotérmico de más de 10 minutos.
No hubo pacientes que experimentaran bloqueo cardíaco posoperatorio y requirieran un marcapasos permanente. Hubo 20 pacientes a los que se los sometió a cuidados paliativos quirúrgicos posteriores. El tiempo desde la reparación truncal inicial hasta la siguiente cirugía fue, en promedio, de 962 días (de 9 a 5614 días). La reconstrucción del flujo de salida del ventrículo derecho con inserción de una ventrículo derecho en el conducto de la arteria pulmonar se llevó a cabo en 21 pacientes. Hubo 3 pacientes a los que se les realizó reconstrucción de la arteria pulmonar y 1 que requirió una reparación del arco aórtico.
Todos los pacientes recibieron el alta hospitalaria en buen estado.
| Categoría |
Cantidad de pacientes |
Edad promedio |
Cantidad de muertes |
Porcentaje de mortalidad |
Mortalidad
según STS7 |
NCH posterior a LOS |
STS posterior a LOS |
| ASO (cirugía de recambio arterial) y ASO/VSD |
41 |
10 días |
1 |
2 % |
11 % |
17 |
N/C |
Análisis:
En 1949, Collett y Edwards publicaron su clasificación anatómica de pacientes con tronco arterial persistente, una clasificación que ha superado la prueba del tiempo1. Según su informe, “un tronco arterial persistente consiste en un tronco arterial único que surge de la parte ventricular del corazón”. Además, “el tronco único recibe sangre de ambos ventrículos y alimenta las circulaciones coronarias, pulmonares y sistémicas”.
En 1968, McGoon describió por primera vez la corrección fisiológica de esta lesión. Él creía que la inserción de un homoinjerto desde el ventrículo derecho en la arteria pulmonar era responsable del éxito definitivo de esta reparación2.
En su informe de referencia, Ebert et al. describieron a una serie de pacientes a los que se los sometió a este procedimiento en los primeros seis meses de vida3. Ellos también advirtieron la importancia de usar un conducto de válvula y realizar la cirugía a una edad anterior al desarrollo de la enfermedad vascular pulmonar. En esta serie, 89 de 100 lactantes sometidos a cirugía sobrevivieron al alta hospitalaria.
A principios de la década de 1990, Hanley et al. comenzaron en Boston a defender el concepto de reparación del tronco neonatal4.
Ellos advirtieron que las complicaciones posoperatorias, como hipertensión pulmonar, eran menos comunes cuando el tronco se reparaba en el período neonatal. Desde ese informe, diferentes centros han demostrado que la reparación neonatal del tronco puede realizarse de forma segura y con pocas complicaciones5,6.
En la actualidad, la reparación del tronco en etapa neonatal se implementa cada vez más. En una revisión de casi 600 pacientes realizada por la STS (Sociedad de Cirujanos de Tórax) en 2012, la mortalidad de todo el grupo fue de alrededor el 11 %. Aquellos pacientes que requirieron una reparación de IAA o reparaciones de la válvula truncal presentaban el riesgo más alto. De los 5 pacientes que requirieron ambos de estos procedimientos solo uno sobrevivió7.
Nuestro programa ha tenido la estrategia de reparación temprana del tronco arterial, con más del 80 % de bebés que se someten a la reparación en el primer mes de vida. Desde el punto de vista filosófico, creemos que los pacientes diagnosticados con tronco arterial se benefician de la cirugía temprana y evitan el estado fisiológico preoperatorio de desventaja, el cual solo puede empeorar después del nacimiento, ya que la resistencia vascular pulmonar comienza a ser menor y la posibilidad de un robo coronario y sistémico que afecta el flujo sanguíneo es real. Por lo general, los pacientes admitidos en nuestra institución tienen prevista la cirugía en la primera semana de vida. Esto incluye a los neonatos nacidos con bajo peso y prematuro. El estado fisiológico poco favorable inherente de estos bebés significa que la espera del crecimiento somático es probable que tenga como consecuencia el aumento deficiente de peso y empeoramiento de la insuficiencia cardíaca antes de la cirugía.
En resumen:
En la era actual, la reparación completa de pacientes con tronco arterial se puede lograr en el período neonatal en la mayoría de los pacientes y obtener baja mortalidad y baja incidencia de la morbilidad a largo plazo. La reconstrucción del RVOT es una nueva cirugía posterior común y, con frecuencia, implica la colocación o el reemplazo de un conducto desde el ventrículo derecho hasta la arteria pulmonar. Es posible que los pacientes en situaciones extremas o con otras comorbilidades significativas reciban cuidados paliativos durante períodos breves mientras se recuperan y esperan la reparación completa. Una técnica quirúrgica meticulosa puede reducir la incidencia de la mayoría de la morbilidad posoperatoria, incluido el desarrollo de taquiarritmia o bloqueo cardíaco.
Imágenes
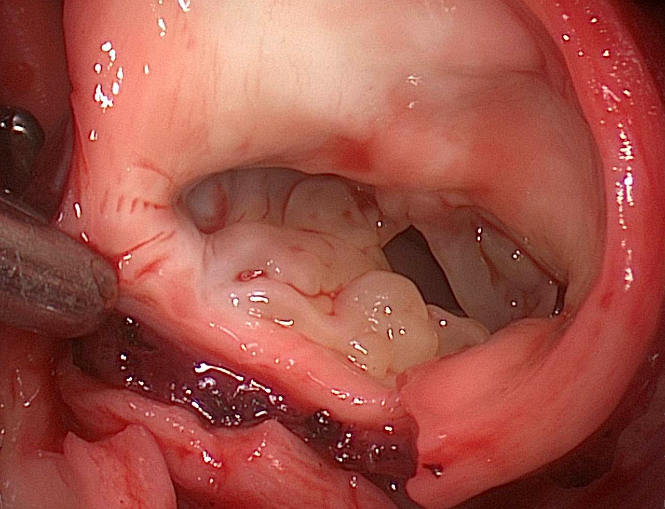
Válvula truncal muy displásica. Las imágenes son cortesía del Dr. Redmond Burke.
Los resultados de pacientes quirúrgicos cardíacos en Nicklaus Children’s Hospital continuaron informándose en tiempo real y esto se ha realizado desde 2001. Los Resultados en Tiempo Real de Nicklaus Children’s Hospital es el sitio web de informe de resultados más integral y transparente disponible hoy en día, con más de 18 años de resultados que pueden consultarse.
Referencias:
- Collett RW, Edwards JE. Persistent truncus arteriosus: a classification according to anatomic types (Tronco arterial persistente: clasificación según los tipos de anatomía). Surgical Clinics of North America. 1 de agosto de 1949;29(4):1245-70.
- McGoonDC, RastelleGC, OngleyPA. An operation for the correction of truncus arteriosus (Cirugía para la corrección del tronco arterial). JAMA1968;205:69.
- Ebert PA, Turley KE, Stanger PA, Hoffman JI, Heymann MA, Rudolph AM. Surgical treatment of truncus arteriosus in the first 6 months of life (Tratamiento quirúrgico del tronco arterial en los primeros 6 meses de vida). Annals of surgery. Octubre de 1984;200(4):451.
- Hanley FL, Heinemann MK, Jonas RA, Mayer JJ, Cook NR, Wessel DL, Castaneda AR. Repair of truncus arteriosus in the neonate (Reparación del tronco arterial en el neonato). The Journal of thoracic and cardiovascular surgery. Junio de 1993;105(6):1047-56.
- Kalavrouziotis G, Purohit M, Ciotti G, Corno AF, Pozzi M. Truncus arteriosus communis: early and midterm results of early primary repair (Tronco arterial común: resultados tempranos y a plazo medio de la reparación primaria temprana). The Annals of thoracic surgery. 1 de diciembre de 2006;82(6):2200-6.
- Bove EL, Lupinetti FM, Pridjian AK, Callow LB, Snider AR, Rosenthal A. Results of a policy of primary repair of truncus arteriosus in the neonate (Resultados de una política de reparación primaria del tronco arterial en el neonato). The Journal of thoracic and cardiovascular surgery. Junio de 1993;105(6):1057-65.
- Russell HM, Pasquali SK, Jacobs JP, Jacobs ML, O’brien SM, Mavroudis C, Backer CL. Outcomes of repair of common arterial trunk with truncal valve surgery: a review of the society of thoracic surgeons congenital heart surgery database (Resultados de la reparación del tronco arterial común con cirugía de válvula truncal: revisión de la base de datos de cirugía congénita del corazón de la STS). The Annals of thoracic surgery. 1 de enero de 2012;93(1):164-9.
Referencias adicionales de interés:
- Anderson RC, Obata W, Lillehei CW. Truncus arteriosus: Clinical study of fourteen cases (Tronco arterial: estudio clínico de catorce casos). Circulation. Octubre de 1957;16(4):586-98.